Un equipo do Centro de Investigación do Cancro de Salamanca (CSIC-USAL) demostrou nun modelo de rato o papel clave que cumpre a mutación xenética dun só xene na iniciación e desenvolvemento dos tumores de células granulosas de adulto (AGCT), un tipo de cancro de ovario. Os resultados, que aparecen publicados na revista Cancer Research, axudan a comprender a natureza e os mecanismos moleculares do xene que codifica a proteína FOXL2, que está relacionado coa maioría destes tumores.
Cando o óvulo se prepara para ser liberado na ovulación, as células da granulosa que o rodean segregan un líquido folicular que crea unha cavidade ou antro. Esta masa de tecido, líquido e óvulo, recibe o nome de folículo de Graaf. Os tumores de células da granulosa de adulto (AGCT) son o tipo máis común de tumores non epiteliais do ovario. Os AGCT ocorren con maior frecuencia despois da menopausa e teñen un prognóstico favorable. As recorrencias agresivas, a miúdo fatais, poden ocorrer ata no 50% dos casos diagnosticados. Como devanditos tumores crecen lentamente, poden reaparecer mesmo 30 anos despois da extirpación do tumor primario.
A maioría destes tumores presenta unha variante no ADN do xene que codifica a proteína FOXL2. Ademais, existen variantes en FOXL2 herdadas pola liña xerminal que son responsables da síndrome de blefarofimose, unha enfermidade hereditaria que se caracteriza por unha malformación da pálpebra e o desenvolvemento de insuficiencia ovárica prematura en moitas das mulleres que o padecen.
A proteína FOXL2
FOXL2 é unha proteína que se une ao ADN regulando a expresión de numerosos xenes en diferentes tecidos, como o tecido mesenquimal en desenvolvemento que dará lugar ás pálpebras e aos folículos ováricos, así como nos ovarios de mulleres adultas. A súa función é esencial para a diferenciación e o mantemento dos ovarios, así como para a represión do programa de diferenciación testicular durante o desenvolvemento embrionario.
A maior parte dos tumores sólidos caracterízanse por presentar varias mutacións en diferentes xenes (oncoxenes ou xenes supresores), que son os responsables causais do desenvolvemento e progresión do cancro. Mediante a secuenciación masiva do xenoma de AGCTs, determinouse desde hai máis dunha década que una das numerosas mutacións presentes nos seus xenomas se localiza no xene FOXL2 en máis do 90% deste tipo de tumores. Cabe destacar que a mutación descrita é idéntica en todos os AGCTs secuenciados e consiste nunha mutación puntual no xene FOXL2. En concreto, prodúcese un cambio da base citosina a guanina, que provoca a substitución dun só aminoácido dos 376 que constitúen a proteína completa FOXL2, isto é, cambia o aminoácido cisteína (C) da posición 134 por un triptófano (W), denominado C134W.
Neste punto, o equipo dirixido por Alberto M. Pendás, do Centro de Investigación do Cancro, en colaboración con Reiner Veitia, da Universidade de París, investigou as mutacións atopadas noutros xenes para determinar se cooperan coa versión mutada de FOXL2 na xeración dos tumores de ovario. Trátase de constatar a causalidade da mutación C134W. Se hai causalidade, a soa presenza de FOXL2-C134W é a única condutora do inicio e progresión dos tumores de ovario.
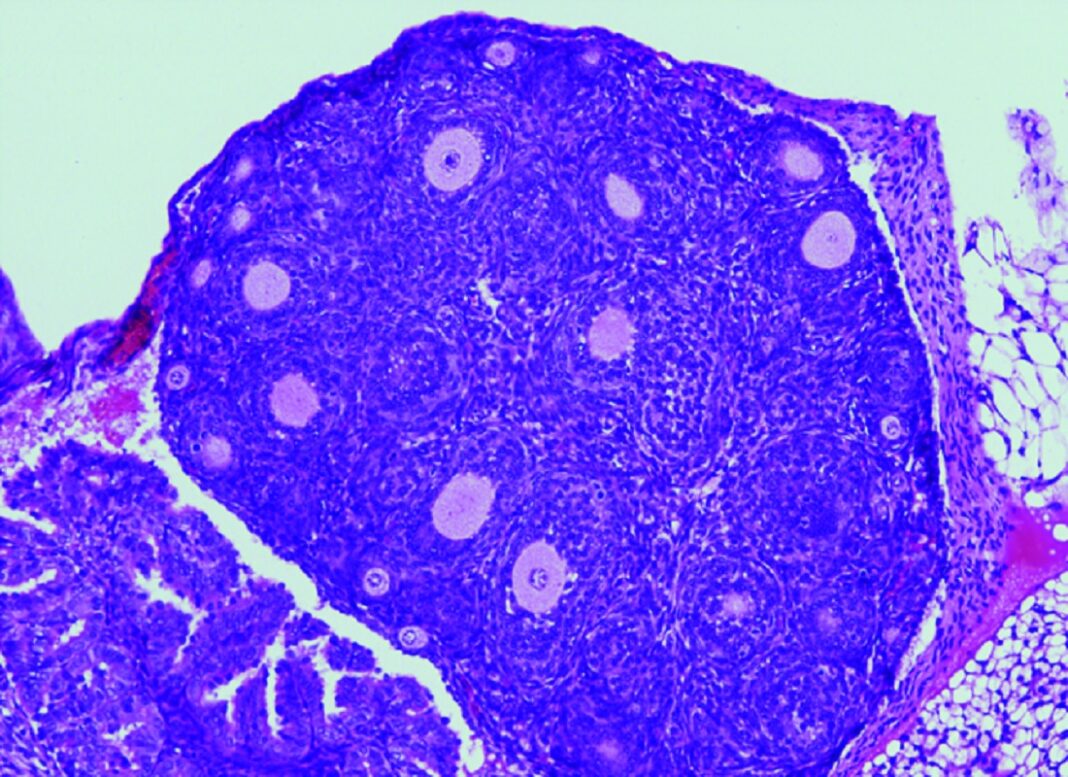
Modelos de rato
“O noso grupo —sinala Elena Llano, da Universidade de Salamanca— desenvolveu por primeira vez un modelo de rato que alberga no seu xene FOXL2 a variante C134W, presente nos tumores humanos, para así poder avaliar in vivo o papel descoñecido de FOXL2 na iniciación e desenvolvemento tumoral. Para a nosa sorpresa, estes ratos presentan a hipoplasia da pálpebra observada na síndrome de blefarofimose. Curiosamente, as femias coa dita mutación presentan unha fertilidade reducida e o que é máis relevante todas desenvolven AGCT espontaneamente. É dicir, progresan gradualmente de ovarios anormais con células da granulosa aberrantes a ovarios con hiperplasia estromal e atipia, que finalmente dan lugar á aparición de tumores ováricos na totalidade dos animais antes dos 18 meses de idade. Por tanto, este proceso parece estar impulsado unicamente pola presenza da variante FOXL2”.
Pendás resalta: “Cando comparamos estes datos con resultados previos en AGCTs humanos observamos vías desreguladas similares. Finalmente, unha análise mutacional dos datos transcriptómicos dos AGCTs do rato suxeriu a ausencia de mutacións condutoras adicionais ademais de FOXL2-C134W. Estes resultados proporcionan un claro exemplo in vivo no que a mutación dun só xene desencadea o desenvolvemento dun tumor con profundas alteracións na expresión de numerosos xenes cruciais para a homeostase normal do ovario”.
Referencia: The oncogenic FOXL2 C134W mutation is a key driver of granulosa cell tumors (Publicado en Cancer Research)